Por Viviane Pereira
A realização de pesquisa clínica com seres humanos é definida com preceitos éticos que já estavam presentes na Resolução 466 de 2012, e a Lei 14.874/2024 traz esses preceitos de forma ainda mais consolidada, organizada e simples.
Entre essas diretrizes, a advogada Camila Martino Parise, sócia de Pinheiro Neto Advogados e responsável pela prática de Life Sciences & Healthcare, destaca a importância da participação voluntária. “O participante precisa ter a vontade de participar da pesquisa e assinar o termo de consentimento livre esclarecido, documento em que constam os critérios, todas as condicionantes, riscos e benefícios. Ele precisa declarar que está ciente e concorda com os termos da pesquisa”.
Há ainda os princípios básicos que se mantêm, como o respeito ao direito, dignidade, segurança e bem-estar do paciente; e a pesquisa deve ser desenvolvida com embasamento científico sólido por uma equipe com competência. Outra condição importante é a garantia da privacidade dos dados e provimento de cuidados assistenciais aos participantes.
Aspectos importantes que apresentam mudanças
Além de consolidar preceitos já estabelecidos, a nova legislação traz algumas inovações, entre as quais a especialista destaca:
- A lei permite, em uma única exceção, a realização de pesquisa clínica sem o termo de consentimento, em caso de emergência. Camila Parise explica que essa condição se aplica especialmente para técnicas cirúrgicas e situações que exigem uma atuação emergencial, como um paciente que chega ao pronto-socorro, está sendo operado, tem uma intercorrência e há uma técnica que está sendo experimentada e pode salvar o paciente. “Não há tempo de coletar o consentimento do paciente ou do seu representante legal, geralmente o médico tem poucos minutos para tomar uma decisão. Nesse caso, ele pode realizar a pesquisa sem o consentimento prévio, mas assim que possível, o participante ou seu representante legal devem ser informados. A partir daí, a decisão de permanecer ou não no estudo é dele. Mas essa é uma exceção”.
- Diferentemente do que acontece em outros países, a participação em pesquisas no Brasil não pode ser remunerada, ou seja, o participante não pode receber para fazer parte da pesquisa – a exceção é o reembolso de despesas de transporte e alimentação. Essa lei inova permitindo o reembolso de material prévio, que é uma compensação financeira das despesas do participante e de seus acompanhantes realizadas previamente à participação do estudo, desde que colocado no protocolo e aprovado pelo comitê de ética em pesquisa. “Há ainda outro ponto, que é a possibilidade de outros tipos de ressarcimento necessários – a lei permite que o protocolo considere outros reembolsos que não apenas transporte, alimentação e despesas com material prévio. Dependerá de uma avaliação caso a caso, dependendo das características do estudo”.
Alteração na dinâmica de aprovação dos projetos de pesquisa
Camila Parise considera uma das grandes inovações trazidas pela nova lei a mudança na dinâmica de aprovação dos projetos de pesquisa.
| ANTES DA NOVA LEI | INOVAÇÃO COM A NOVA LEI |
| A maioria dos projetos era aprovada pelo Comitê de Ética em Pesquisa (CEP) da instituição e, em alguns casos, para a pesquisa ser conduzida havia a aprovação da Comissão Nacional de Ética em Pesquisa (Conep). | Não existe mais o conceito de dupla aprovação. A aprovação é feita em uma única esfera – o sistema CEP e Conep foi substituído pelo Sistema Nacional de Ética em Pesquisa. |
Esse Sistema Nacional de Ética em Pesquisa é composto pela Instância Nacional de Ética em Pesquisa e a Instância de Análise Ética em Pesquisa, que são os Comitês de Ética em Pesquisa (CEPs) – não há mais a Conep.
A sócia de Pinheiro Neto Advogados explica que essa instância nacional vai regulamentar a pesquisa, apoiar, capacitar e fiscalizar os CEPs, atuando como instância recursal. “Agora, um processo que for rejeitado pelo CEP poderá apresentar recursos, que será avaliado pela Instância Nacional de Ética em Pesquisa, que é interdisciplinar, independente, e integra o Ministério da Saúde, sob a coordenação da Secretaria de Ciência e Tecnologia”.
Alguns aspectos, como a composição da instância, ressalta a advogada, serão ainda definidos por decreto, ou mesmo regulamentações e resoluções
A Instância de Análise Ética em Pesquisa, que são os CEPs, será responsável pela avaliação ética de todos os projetos.
“A diferença é que agora temos os CEPs credenciados e os CEPs acreditados – os projetos de alto risco vão para os CEPs acreditados e os de baixo risco vão para os CEPs credenciados”, diz. “Podemos fazer um paralelo: antes os projetos de alto risco iam para a Conep e agora vão para os CEPs acreditados. O problema é que não temos muitos CEPs acreditados no Brasil, e podemos ter um gargalo importante, dificultando a avaliação de todos os projetos submetidos”. A definição para atribuição do nível de risco será determinada por regulamento.
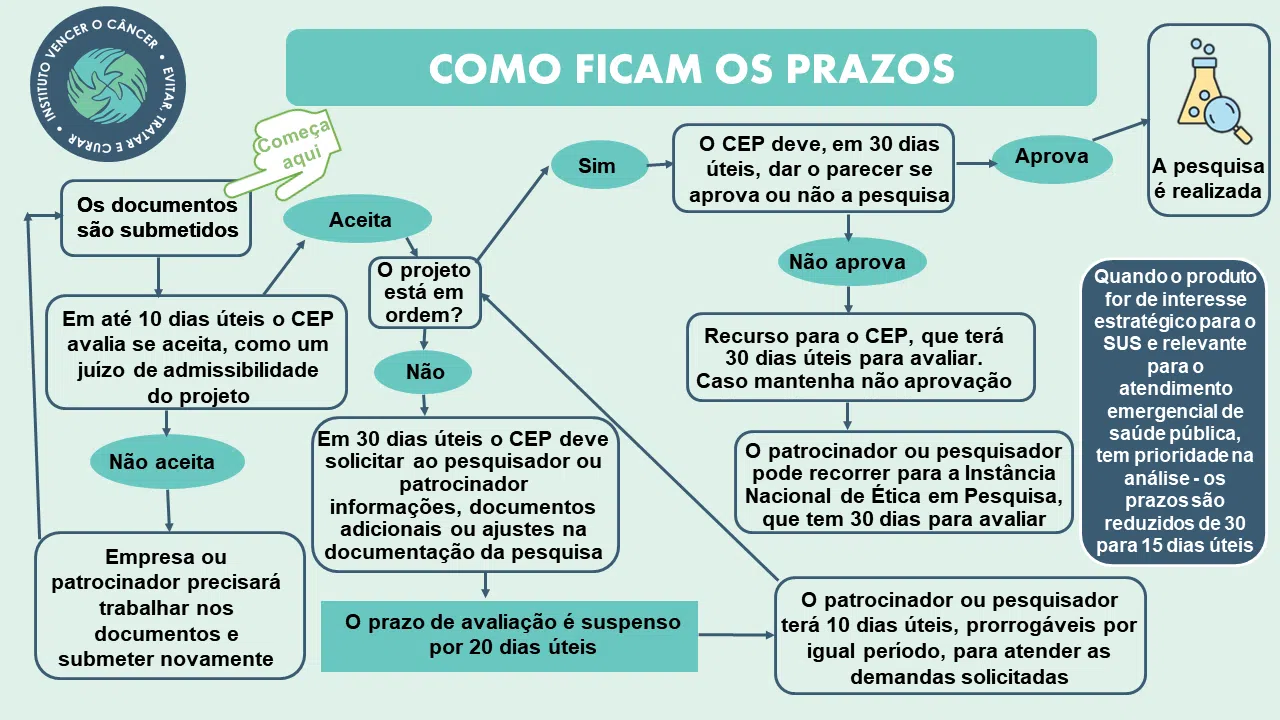
Lei cria prazos bem objetivos para avaliação
Camila Parise considera um ganho de previsibilidade a criação de prazos bem objetivos para avaliação das pesquisas – embora ainda existam pontos que precisarão de ajustes, como a infraestrutura necessária para que os CEPs possam cumprir os prazos, e adaptações para as demandas de projetos que passarão a ser submetidos aos CEPs acreditados.

Leia também: Pesquisa Clínica no Brasil Avança com Nova Lei em Vigor.