O tratamento do câncer de mama evoluiu muito nos últimos anos. Outrora, quando surgia um tumor, a mama era removida completamente, incluindo o músculo que ficava abaixo dela e todos os gânglios da região axilar. Atualmente, as cirurgias costumam ser bem menos invasivas.
Com frequência, faz-se necessário apenas a retirada de pequenos fragmentos da mama (quadrantectomia ou setorectomia) e de alguns gânglios debaixo do braço. Para a maioria dos casos, a mutilação tornou-se obsoleta.
Para escolher o melhor tratamento, leva-se em consideração diversos fatores, como características do tumor, idade da paciente e número de gânglios (linfonodos) axilares comprometidos, além de fatores que caracterizam a biologia da doença, como status do receptor de estrógeno e progesterona, além do status de HER-2, grau histológico e índice de proliferação Ki-67.
No momento do diagnóstico, são identificadas as pacientes com risco mais elevado de apresentar focos microscópicos de células tumorais em algum outro órgão. Nesses casos, está indicado um tratamento complementar adjuvante (após a cirurgia) e/ou neoadjuvante (antes da cirurgia), que tem por objetivo reduzir o risco de recidiva e pode incluir: hormonioterapia, quimioterapia, anticorpos monoclonais, imunoterapia, anticorpos conjugados à droga, terapia-alvo e radioterapia.
A escolha do tipo de tratamento complementar irá depender principalmente da magnitude do risco de recidiva. Esse risco, por sua vez, depende do estádio clínico da doença (grupo de casos semelhantes separados em categorias relacionadas com a gravidade da doença), das características do tumor descritas na patologia, da idade e da condição clínica da paciente. Quanto maior o risco de recidiva da doença, mais agressivo deve ser o tratamento, empregando esquemas de quimioterapia mais intensos e eficazes.
Não é possível discutir os esquemas ideais para cada situação porque, se combinarmos todas as possibilidades de cirurgia, quimioterapia, radioterapia etc., teremos mais de 400 tratamentos possíveis. Por essas razões, vamos relacionar apenas as condutas gerais, de acordo com o estadiamento clínico.
Estádios do câncer de mama
Para tentar agrupar casos semelhantes e separá-los em categorias relacionadas com a gravidade da doença, costumamos dividi-la em estádios. Os quatro estádios do câncer de mama são mostrados abaixo:


Tipos de Tratamento
É importante ressaltar que, em ambiente multidisciplinar, os médicos especializados em câncer de mama nas áreas de cirurgia, oncologia clínica e radioterapia, devem trabalhar em conjunto para elaborar um plano de tratamento do paciente, que em geral combinará diferentes modalidades de terapias com o objetivo de se obter os melhores resultados.
As principais características que determinam quais tratamento serão incluídos no manejo do pacientes com doença localizada, e qual sequência é a ideal, são a biologia e o estadiamento do tumor e a condição de saúde do paciente.
As opções e recomendações de tratamento são bastante personalizadas e dependem de vários fatores, incluindo: o subtipo biológico do tumor (determinado pelo status do receptor de estrógeno e progesterona, além do status de HER-2), a condição dos linfonodos axilares, o tamanho do tumor na mama e marcadores genômicos, como Oncotype Dx ou MammaPrint, se apropriado.
Adicionalmente, é fundamental levar em consideração a idade, a condição de saúde geral, o status da menopausa, além das preferências pessoais de cada paciente, que são de extrema relevância. A seguir, dividimos o tratamento da doença localizada nos diferentes subtipos biológicos de câncer de mama, a saber: luminal, triplo negativo e HER-2 positivo.
Os tumores luminais são aqueles que têm expressão de receptores hormonais (estrógeno e/ou progesterona), mas o HER-2 é negativo. Os tumores HER-2 positivos são aqueles que têm hiperexpressão da proteína HER-2, independentemente da expressão dos receptores hormonais.
Os tumores triplo negativos são aqueles que não têm expressão dos três receptores (estrógeno, progesterona e HER-2), daí o nome.
Tratamento Luminal – Estágios I-III
Nos tumores pequenos e com expressão de receptores hormonais, o cirurgião geralmente remove a parte da mama que contém a lesão (o chamado quadrante ou setor). Ao mesmo tempo, realiza a pesquisa do linfonodo sentinela (em geral, é somente um, mas pode haver mais), onde as células malignas têm maior probabilidade de alojar-se, caso tenham “escapado” do tumor primário.
Nos tumores relativamente grandes (entre 2 e 5 cm) pode ser necessário fazer mastectomia. No entanto, após discussão com o médico cirurgião, o oncologista clínico pode administrar quimioterapia antes da cirurgia (também chamada de neoadjuvante) com a intenção de reduzir as dimensões da lesão.
Se houver grande diminuição ou mesmo desaparecimento da lesão, em alguns casos é possível preservar a mama retirando somente o quadrante em que está o tumor. Não há uma regra geral para essas situações, as decisões são tomadas caso a caso.
Além disso, em pacientes com comprometimento linfonodal limitado, a quimioterapia neoadjuvante é capaz de levar à erradicação completa de todas as células presentes nos linfonodos, permitindo a realização de linfonodo sentinela (quando se retira apenas um ou poucos gânglios da axila) ao invés do esvaziamento axilar (quando se retiram múltiplos gânglios da axila responsáveis pela drenagem da região da mama).
Nos pacientes que não possuem indicação de quimioterapia neoadjuvante, após a cirurgia definitiva da mama o médico irá verificar se existe ou não indicação de quimioterapia e/ou hormonioterapia, com o intuito de reduzir o risco de recidiva.
Há casos em que a indicação de quimioterapia adjuvante (ou seja, realizada após a cirurgia) é muito controversa, e as opiniões entre os especialistas irão divergir. Assim, ouvir uma segunda opinião de especialista na área é por vezes recomendável.
Atualmente, testes genéticos realizados no próprio tumor removido podem auxiliar, em alguns casos, a determinar melhor o tratamento adjuvante, especificamente se a quimioterapia será ou não necessária. Os dois testes mais usados são o OncotypeDx e o Mammaprint.
Ambos são testes de alto custo e realizados nos Estados Unidos. A indicação do contexto em que tais testes podem ser aplicados depende do tamanho do tumor, do status do linfonodo da axila, da idade e do status menopausal da paciente. Cabe ao médico decidir qual o melhor teste para cada caso.
A hormonioterapia adjuvante é recomendada em todos os casos em que o tumor tiver receptores hormonais positivos, irrespectivo do status de expressão de HER-2. Quando prescrita, ela deve ser sempre iniciada após o término da quimioterapia.
Atualmente, em tumores que possuem alto risco de recidiva, definidos pela presença de 4 ou mais linfonodos axilares ou pelo comprometimento linfonodal mais limitado (1 a 3 linfonodos comprometidos), mas com outros fatores de risco, como grau histológico 3, tamanho do tumor acima de 5 cm ou índice de proliferação Ki-67 acima de 20%, deve-se incluir o abemaciclibe, uma droga alvo que inibe as ciclinas 4 e 6, de forma concomitante à hormonioterapia durante 2 anos. Nesse contexto, o abemaciclibe reduziu substancialmente o número de pacientes que apresenta recidiva da doença.
Tratamento Triplo Negativo – Estágios I-III
Os tumores triplo negativos que possuem 1 cm ou mais em tamanho, irrespectivamente do status de linfonodo axilar, devem ser manejados com quimioterapia neoadjuvante. Em geral, é recomendado um esquema de tratamento que combina as drogas quimioterápicas mais importantes no arsenal terapêutico do câncer de mama combinado à imunoterapia.
Em geral, durante a quimioterapia, utiliza-se o suporte de medicação que estimula a produção de granulócitos, as células de defesa. O esquema mais usado é chamado de AC-T dose densa. O AC inclui a medicação doxorrubicina, que tem cor vermelha, e a ciclofosfamida.
Este esquema deve ser administrado a cada 14 dias, por isto o nome dose densa, e possui implicações diretas no aumento da chance do cura do paciente. A seguir, as pacientes recebem uma medicação chamada paclitaxel que é administrada semanalmente por 12 semanas.
Pode-se administrar o mesmo esquema iniciando pelo paclitaxel seguido pelo esquema de AC dose densa. Concomitante à quimioterapia, deve-se utilizar pembrolizumabe, um agente imunoterápico que estimula a resposta imune. O acréscimo de pembrolizumabe à quimioterapia está indicado para tumores que possuem tamanho superior a 2 cm ou comprometimento de linfonodo axilar.
Ressaltamos que, em geral, o pembrolizumabe é mantido por 9 ciclos adicionais após a cirurgia definitiva de mama. Na doença localizada, sabemos que o tempo para início de quimioterapia é crucial para aumentar as chances de cura do paciente com esse subtipo biológico. Adicionalmente, o tratamento neoadjuvante permite a oportunidade de avaliação de resposta ao tratamento quimioterápico “in vivo”. Nesse contexto, o conhecimento do status de mutação germinativa em BRCA 1 ou 2 é fundamental.
Mutações nos genes BRCA 1 ou 2 reconhecidamente aumentam o risco de desenvolvimento de câncer de mama. Em uma paciente com diagnóstico de câncer de mama triplo negativo, a recomendação para realização do teste que avalia a presença ou ausência de alterações nesses genes é fundamental, independentemente da história da família ou da idade da paciente.
Se a paciente for portadora de mutação em BRCA 1 ou 2 e houver doença residual na cirurgia após a quimioterapia neoadjuvante, deve-se discutir o tratamento com olaparibe, uma droga alvo que inibe uma enzima denominada PARP.
Nos pacientes que não evoluem com erradicação completa do tumor após quimioterapia neoadjuvante e não são portadores de mutação em BRCA 1 ou 2, está indicado o uso de uma quimioterapia adicional por via oral, chamada capecitabina. No tumores triplo negativos com menos de 1 cm e sem acometimento de gânglios, em geral é realizada a cirurgia primeiro, com posterior avaliação patológica do tecido mamário e do linfonodo sentinela ressecados para definição do melhor regime de tratamento complementar. Nos casos de tumores menores que 6 mm e com linfonodo sentinela negativo, em geral não se administra quimioterapia adjuvante, mas o oncologista irá discutir caso-a-caso.
Tratamento HER-2 – Estágios I-III
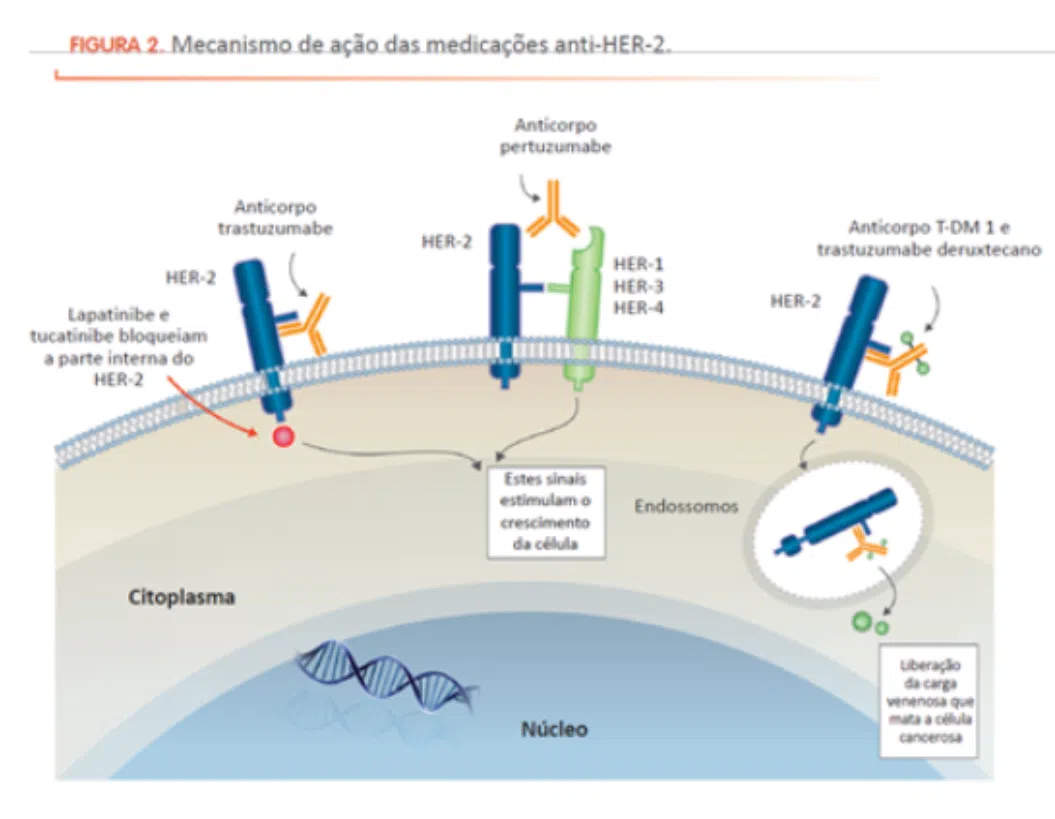
Os tumores HER-2 positivos que são elegíveis para quimioterapia neoadjuvante incluem aqueles com lesão na mama maior do que 2 cm e/ou com comprometimento de linfonodo da axila. Nesse caso, adiciona-se à quimioterapia um anticorpo anti-HER-2 chamado trastuzumabe combinado a outro anticorpo denominado pertuzumabe, que age de maneira sinérgica ao trastuzumabe.
A resposta à terapia neoadjuvante é fundamental na escolha da terapia anti-HER-2 recebida após a cirurgia: se houver resposta completa na patologia da cirurgia (erradicação total do tumor na mama e gânglios axilares), mantém-se os anticorpos trastuzumabe e pertuzumabe.
Já se houver doença residual em mama e/ou nos linfonodos, o tratamento é trocado para outro anticorpo, mas nesse caso conjugado a um agente quimioterápico, denominado T-DM1. Em contraste, se o tumor HER-2 positivo tiver tamanho inferior a 2 cm e não comprometer gânglios na axila, o paciente é operado, sendo avaliado posteriormente para tratamento complementar.
Em geral, se a cirurgia confirmar uma neoplasia pequena e sem comprometimento de linfonodos, a quimioterapia poderá ser descalonada, isto é, menos agressiva, usando-se um agente único denominado paclitaxel semanal, em combinação com trastuzumabe por um total de 12 semanas e depois trastuzumabe isolado até completar 1 ano. Em algumas situações, de acordo com discussão em relação ao perfil de efeitos colaterais, pode ser também optado pelo uso de T-DM1 após a cirurgia.
Radioterapia adjuvante
Todas as pacientes (exceto raros casos) que tiveram remoção cirúrgica de somente um quadrante da mama necessitam de radioterapia após a cirurgia (adjuvante) para destruir possíveis focos malignos microscópicos persistentes.
Nas pacientes que foram submetidas a mastectomia, a radioterapia adjuvante está indicada nos casos em que o tumor é grande (> 5 cm) ou quando a paciente tiver mais de três linfonodos com metástases. Além disso, pode-se optar por oferecer radioterapia adjuvante em pacientes com comprometimento linfonodal mais limitado (1-2 linfonodos comprometidos), principalmente nas relativamente jovens e com subtipo biológico mais agressivo.
Doença Metastática
Conceitos Gerais
A escolha do tratamento das pacientes que apresentam câncer de mama com disseminação para outros órgãos (chamado de metástases) depende de quanto o tumor já se espalhou, de sua biologia e da idade da paciente, além de suas comorbidades e preferências pessoais.
Na doença disseminada, a radioterapia é usada para produzir paliação de sintomas, em caso de envolvimento ósseo com dores de difícil controle, de metástases cerebrais e em outras situações mais raras.
Luminal
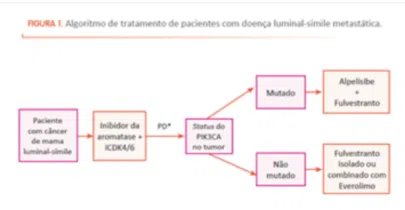
O tratamento padrão nesse contexto é representado por hormonioterapia combinada a uma droga-alvo. A primeira opção de tratamento consiste na combinação de inibidores de aromatase com os chamados inibidores de ciclina 4/6 (CDK4/6), uma classe de medicamentos orais disponíveis comercialmente no Brasil (palbociclibe, ribociclibe ou abemaciclibe).
A associação dessas duas modalidades de tratamento acarreta controle bastante adequado da doença, com bom perfil de tolerância e manutenção de qualidade de vida. Os inibidores de ciclina revolucionaram o tratamento da doença luminal avançada, com aumento do controle da doença e da sobrevida das pacientes em relação à hormonioterapia isolada.
Raramente, se a paciente apresentar volume de doença muito grande, com iminente risco de morte e comprometimento da função dos órgãos vitais, pode ser necessária a realização de quimioterapia, em geral com a combinação de mais de um agente quimioterápico.
Outras opções, após falha ao regime anteriormente mencionado, consistem em hormonioterapia combinada a outras drogas alvo. Portanto, no presente, o manejo de pacientes com câncer de mama avançado com expressão de receptores hormonais, inclui o conhecimento das alterações moleculares presentes no tumor, pois uma droga que bloqueia especificamente a alteração no gene PIK3CA, denominada alpelisibe, é disponível.
Se houver essa mutação, está indicada a combinação de alpelisibe com fulvestranto, um agente bloqueador endócrino. Se não houver a mutação, há ainda a opção de outra droga alvo combinada à terapia endócrina, o everolimo, o qual consegue restaurar em parte a sensibilidade à hormonioterapia.
Ressaltamos que pode ser necessário, em algum momento dentro da evolução da doença avançada de pacientes com câncer de mama e expressão de receptor hormonal, o uso de quimioterapia. A necessidade dessa modalidade de tratamento é estabelecida mediante o esgotamento das opções de hormonioterapias combinadas à drogas alvo ou diante do volume e da sintomatologia da doença.
Após exposição a uma linha de quimioterapia, é necessário o conhecimento do status da expressão do HER-2. Se a doença for classificada com baixa expressão de HER-2, ela é denominada HER-2 low (na patologia será reportado HER-2 +1 ou HER-2 +2 com FISH negativo) e, nesse caso, o uso de uma medicação chamada trastuzumabe deruxtecana é indicado.
Trata-se de um anticorpo conjugado a um agente quimioterápico, que utiliza a baixa expressão de HER-2 como âncora. O anticorpo se liga ao HER-2 e libera a quimioterapia dentro da célula do tumor e também pode acometer as células adjacentes. O algoritmo a seguir sumariza o modo de pensar do oncologista clínico:

Triplo Negativo
As opções disponíveis de tratamento na doença metastática consistem em quimioterapia, quimioterapia combinada à imunoterapia, drogas inibidores de PARP e anticorpos conjugados à droga.
A avaliação da escolha de tratamento depende de alguns parâmetros, sendo o primeiro deles a análise da expressão de PD-L1 na biópsia do tumor. Essa avaliação pode ser realizada tanto no tecido primário da mama, quanto na lesão metastática.
Ressaltamos que a taxa de positividade é muito superior quando analisado no tumor da mama em relação aos demais tecidos, e por isso esse deve ser o material de escolha. Quando o PD-L1 for adequadamente positivo, a paciente deve ser receber, como tratamento inicial, a combinação de imunoterapia com quimioterapia.
O segundo parâmetro a ser estudado é a presença de mutações germinativas (herdadas do pai ou da mãe) nos genes BRCA 1, 2 e PALB2, além da avaliação de mutação adquirida (somática) no tumor em BRCA 1 e 2. Se a paciente for portadora de mutação germinativa do BRCA1 ou BRCA2, ela pode ser tratada com uma medicação que bloqueia uma enzima que repara danos no DNA da célula, chamada de inibidores da PARP.
A única aprovada no Brasil é o olaparibe, que tem ótima eficácia nesta população de pacientes. O olaparibe é também muito eficaz nos casos com mutação germinativa do PALB2, assim como nas mutações somáticas do BRCA 1 ou 2, embora não seja aprovada para estas indicações em bula.
Atualmente, o sacituzumabe govitecana, um anticorpo conjugado à droga, é indicado em pacientes previamente tratados com quimioterapia no cenário de doença avançada. A medicação é claramente superior à quimioterapia nesse contexto, sendo uma valiosa opção nesse grupo de pacientes.
Nesse subtipo de câncer de mama também é importante avaliar a classificação da expressão da proteína HER-2. Se houver uma baixa expressão de HER-2 (na patologia será reportado como HER-2 +1 ou HER-2 +2 com FISH negativo), o paciente também é candidato ao uso de outro anticorpo conjugado à droga, chamado de trastuzumabe deruxtecana.
HER-2 positivo
Para o tratamento da doença avançada de tumores com expressão de HER-2, as opções disponíveis consistem em quimioterapia combinada a trastuzumabe e pertuzumabe; trastuzumabe deruxtecana; trastuzumabe entansina (também chamado de T-DM1); quimioterapia combinada a trastuzumabe; trastuzumabe combinado a tucatinibe e capecitabina; trastuzumabe combinado a lapatinibe; e lapatinibe combinado a capecitabina.
Esse subtipo de câncer de mama possui um grande repertório de opções disponíveis para tratamento, sendo que uma constante consiste em sempre manter o eixo da via do HER-2 bloqueado, em todas as linhas de tratamento.
Adicionalmente, é de extrema importância o conhecimento do status dos receptores hormonais, uma vez que, se positivo, o receptor de estrógeno interage com o HER-2, fazendo com que, em alguns momentos do tratamento, o paciente possa receber uma hormonioterapia combinada à terapia anti-HER-2.

Atualização: Dra. Debora de Melo Gagliato Jardim CRM: 124.597 Oncologista Clínica na BP – A Beneficência Portuguesa de São Paulo
Apoio: Dra. Jéssica Ribeiro GomesCRM: ES 10.466 Oncologista Clínica na Rede Meridional/ES
Vídeo: Dr. Antonio Buzaid





